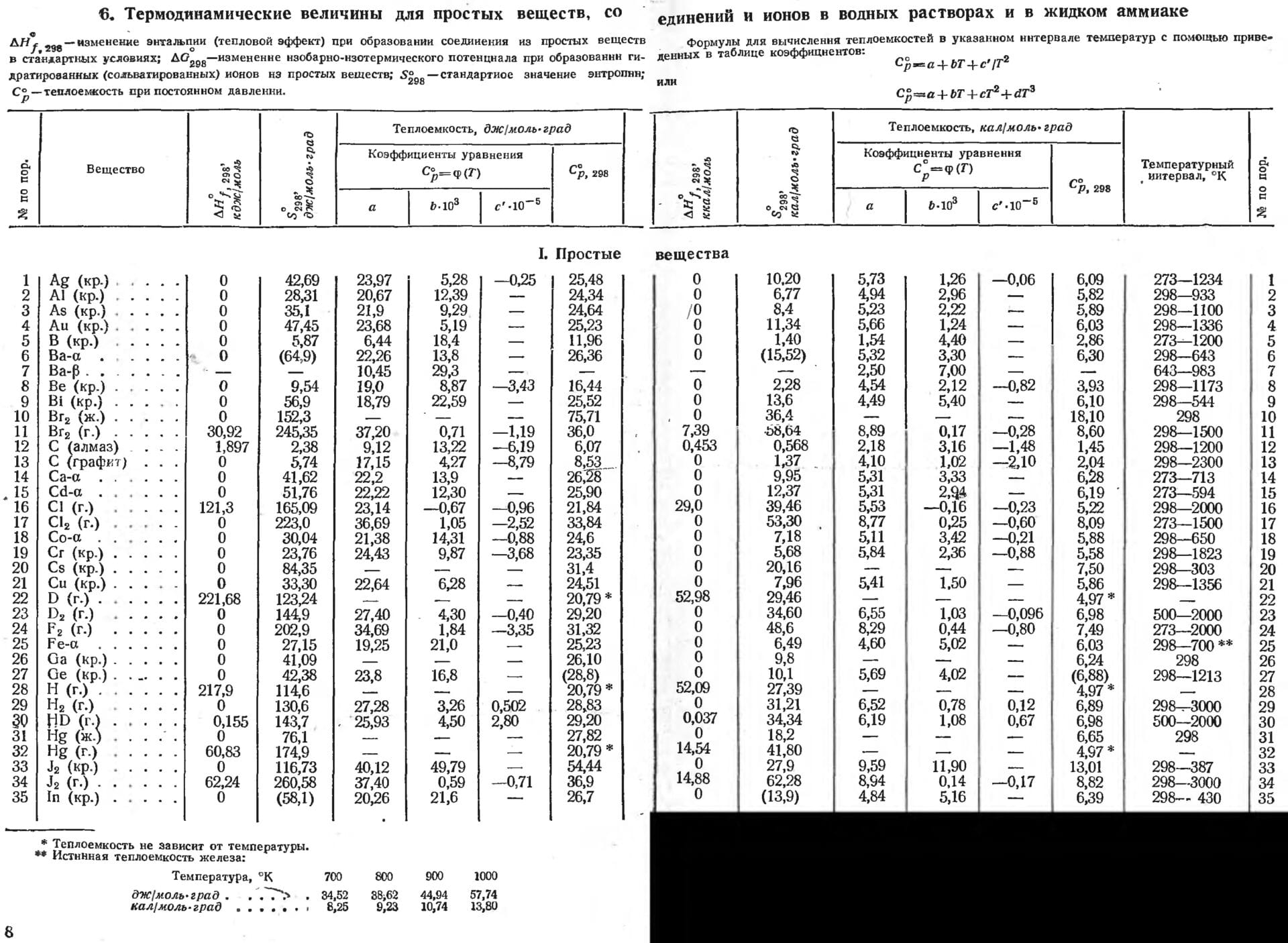
Использование энтальпии позволяет сократить объем справочных данных об энергетических параметрах реакций.
Представьте, что у вас есть 100 веществ. Вообще говоря, любое вещество/комбинация может переходить в любое другой вещество/комбинацию и тогда возможно ~2¹⁰⁰~10¹⁰ реакций с энергетическими параметрами.
А теперь представьте, что химических веществ известно около 20 млн.!
Но можно реализовать другой подход. Для каждого из 100 этих веществ определить энергию образования из исходных простейший веществ Н2(г), О2(г), С(гр(афит)) , Аr(г) и т. д.
Это и называют энтальпией ∆fH0298 , где:
- ∆ – дельта – разница энергий исходных и образованного вещества
- f – formation (образование)
- верхний индекс 0 – нормальное атмосферное давление
- нижний индекс 298 – температура исходных и конечного вещества 298o K (25o С)
И тогда, исходя из простого следствия закона сохранения энергии в химических реакциях (в химии он носит название закон Гесса), энергетический выход реакции любого вещества/комбинации веществ в другое вещество/комбинацию будет простая разница суммы энтальпий исходных и конечных веществ учетом стехиометрических коэффициентов.
Звучит может страшно и непонятно, но на самом деле все просто. Например, найдем теплоту сгорания метана, используя справочные данные по энтальпии.
CH4 + 2O2 -> CO2 + 2H2O
Берем данные по энтальпии из справочника «Краткий справочник физико–химических величин» под редакцией К.П. Мищенко для конечного состояния воды в виде жидкости^
и получаем теплоту сгорания метана:
| CH4 | O2 | CO2 | H2O(ж) | |
| Энтальпия веществ | -74,85 | 0 | -393,51 | -285,83 |
| Энтальпия с учетом стехиометрических коэффициентов | -74,85 | 0 | -393,51 | -571,66 |
| Сумма энтальпий исходный и конечных веществ | -74,85 | -965,17 | ||
| Энергетическая ценность сгорания CH4 , высшая |
-890,32 | |||
Сравниваем с данными, которые непосредственно приведены в этом же справочнике: -890,31 Различие на одну сотую в последнем знаке связана с ошибками округления.

Вычисляем для конечного состояния воды в виде пара:
| CH4 | O2 | CO2 | H2O(г) | |
| Энтальпия | -74,85 | 0 | -393,51 | -241,82 |
| Энтальпия с учетом стехиометрических коэффициентов | -74,85 | 0 | -393,51 | 483,64 |
| Сумма энтальпий исходный и конечных веществ | -74,85 | -877,51 | ||
| Энергетическая ценность сгорания 1 моля CH4 , низшая | -802,3 | |||
Для конечного состояния воды в виде пара в справочнике уже не приводится значения. Это как раз иллюстрация того, что, с чего начиналась эта статья!))
Еще раз: добавлена энтальпия для воды в виде пара и сразу появляются энергетические значения и для метана и для пропана и тд и тд!
[box type=”note” align=”” class=”” width=””]В заключении обращу внимание, что теплота парообразования (разница для энтальпий воды в виде пара и жидкости), согласно справочника составляет 44,01 кДж/моль, что отличается от “привычного” значения парообразования для воды 40,66 кДж/моль. Связано это с тем, что теплота парообразования дана при 1000 С, а в данном случае это теплота парообразования при 2980 К = 250 С[/box]
[is_logged_in]
https://chemhelp.ru/handbook/tables/thermodynamic_data/
https://bookree.org/reader?file=476060&pg=9
[/is_logged_in]